Oi galera, vamos esclarecer um pouco da matéria:
- Isótopo
Para a compreensão do conceito de isótopo, se faz necessário entender algumas características dos átomos.
Cada átomo algumas características que o identificam. O número de massa é a soma de prótons e nêutrons do átomo. O número atômico corresponde ao número de prótons existentes no núcleo do átomo e é importante porque determina qual é o elemento químico, já que cada elemento tem o mesmo número de prótons sempre. O Cálcio, por exemplo, possui o número atômico (Z) igual a 20.
Os isótopos são dois átomos do mesmo elemento químico com números de massa (A) diferentes e números atômicos (Z) iguais. A diferença se encontra no número de nêutrons. Os isótopos podem diferir em algumas características, como a densidade.
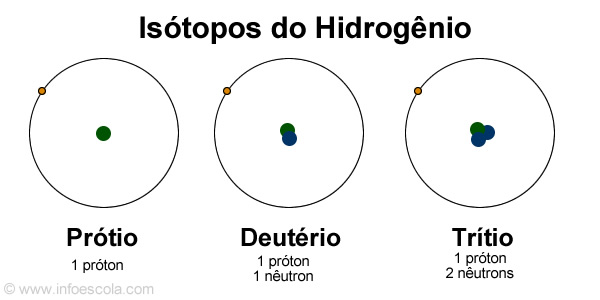
O Hidrogênio possui três isótopos estáveis: o prótio, com um próton e nenhum nêutron – corresponde a 99,98% de todos os átomos de hidrogênio; o deutério, com um nêutron e o trítio, com dois nêutrons. Em laboratório já foram construídos isótopos de hidrogênio com até seis nêutrons. Não apenas com o Hidrogênio, mas na natureza há muitos isótopos, como o Carbono.
 |
| http://www.infoescola.com/quimica/isotopos/ |
Vejam mais :
O radioisótopo, por sua vez, é o átomo que apresenta um núcleo radioativo. Quando o radioisótopo se transforma em um isótopo, libera uma energia chamada de partículas alfa, partículas beta ou radiação gama. Os radioisótopos são muito utilizados em tratamentos médicos e diagnósticos.
O Carbono 14, utilizado para a datação de fósseis, podendo datar objetos de milhões de anos, é um isótopo radioativo, além disso, pode ser utilizado em estimação e pesquisa de velocidade e fluxo de águas subterrâneas, recurso especialmente importante em razão da escassez e poluição crescentes de águas superficiais.
Além do Hidrogênio e Carbono, outro isótopo encontrado em abundância na natureza é o Cloro, havendo os elementos Cl-35 e Cl-37.
Fontes:
AMARAL, Luciano do. Química. Loyola: São Paulo. 1995.
ZAGATTO, E.; CRISTINA, A.; CALHEIROS, D.; FURLAN, S. Isótopos de Carbono em Estudos Ambientais. 15 p. 2000. Disponível em http://web.cena.usp.br/apostilas/Zagatto/FAN2-CarbonoAmbiente.doc. Acesso em 29 de jan. 2010.
http://www.infoescola.com/quimica/isotopos/
______________________________________________________
- Isóbaros
São elementos diferentes, portanto, com números atômicos diferentes, mas que possuem o mesmo número de massa. Isso não significa que os números de prótons e nêutrons sejam iguais; o que é igual é a soma desses números, ou seja, a massa do átomo. O termo isóbaro vem do grego isso = mesmo e baros = peso.
Exemplo:
Cálcio (Ca): Z = 20; n = 20; A = 40 / Argônio (Ar): Z = 18; n = 22; A = 40 / Potássio (K): Z = 19; n = 21; A = 40
______________________________________________________
- Isótonos
Isótonos são átomos que possuem números atômicos (Z) e de massa (A) diferentes, mantendo o mesmo número de nêutrons. Isso pode ocorrer entre elementos químicos diferentes. Tem-se, portanto, como exemplo o Cálcio e o Cloro.
O Cálcio tem o número de massa (A) igual a 40 e o número atômico (Z) igual a 20. O Cloro possui número de massa (A) igual a 37 e o número atômico (Z) igual a 17.
Ambos possuem a mesma quantidade de nêutrons, igual a 20, que pode ser calculada subtraindo-se o número atômico do número de massa.
Desta forma, tem-se:
Cálcio40: A – Z = N; 40 – 20 = 20
Cloro37: A – Z = N; 37 – 17 = 20
O elemento em comum entre ambos os elementos e que caracteriza sua classificação como isótono é o mesmo número de nêutrons.
Fontes: http://www.infoescola.com/quimica/isotono/
Nenhum comentário:
Postar um comentário